中國網(wǎng)3月20日訊3月19日晚間,廣東利泰制藥發(fā)布招股說明書,公司擬登陸深交所,發(fā)行2933.88萬股。招股書顯示,氨基酸大輸液為公司主要銷售產(chǎn)品,所占公司業(yè)務(wù)比重極大。但中國網(wǎng)財經(jīng)在查閱諸多歷史資料后發(fā)現(xiàn),該公司的主營產(chǎn)品——多個批次的氨基酸注射液產(chǎn)品質(zhì)量不合格,這在相關(guān)省份(如江西、河南、廣東等)藥品檢測網(wǎng)站和媒體報道中有據(jù)可查,且這種狀況從06年就已開始。
06年至今多批次產(chǎn)品被檢出不合格
中國網(wǎng)財經(jīng)查閱歷史資料后發(fā)現(xiàn),利泰制藥涉及的不合格產(chǎn)品項(xiàng)目可謂“全面開花”,不僅公司的主打產(chǎn)品氨基酸注射液有質(zhì)量不過關(guān)的“劣跡”、氯化鈉注射液、葡萄糖等產(chǎn)品均產(chǎn)生過質(zhì)量問題,有過檢測不合格的紀(jì)錄。
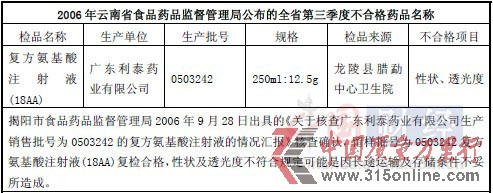
在2006年云南省食品藥品監(jiān)督管理局公布的第三季度不合格藥品名單里,利泰制藥的生產(chǎn)批號是0503242的復(fù)方氨基酸注射液不合格,不合格項(xiàng)目為產(chǎn)品的“性狀、透光度”。
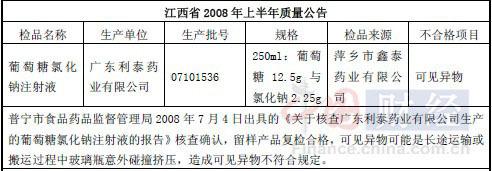
而在2008年,江西省各級食品藥品監(jiān)督管理部門對省內(nèi)藥品的檢測結(jié)果顯示,利泰制藥的生產(chǎn)批號是07101536的葡萄糖氯化鈉注射液檢驗(yàn)不合格,檢測結(jié)果顯示,產(chǎn)品不合格的項(xiàng)目為“可見異物”。
而后,質(zhì)量問題轉(zhuǎn)移到廣東省。在2009年,廣東省第二季度產(chǎn)品質(zhì)量公告顯示,利泰制藥的生產(chǎn)批號是08030542的氯化鈉注射液被檢測為不合格,檢測結(jié)果顯示,產(chǎn)品不合格的項(xiàng)目為“可見異物”,公司因此遭受了普寧市食品藥品監(jiān)督管理局的處罰。
而翻看利泰制藥招股書可發(fā)現(xiàn),公司對此次處罰事件的描述為“該處罰不構(gòu)成重大違法行為。”

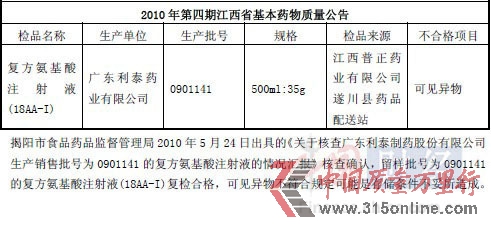
2010年,仍是在江西省,利泰制藥的生產(chǎn)批號是0901141的復(fù)方氨基酸注射液被檢測為質(zhì)量不合格;檢測結(jié)果顯示,產(chǎn)品不合格的項(xiàng)目仍為“可見異物”。
《中華人民共和國藥典》2005年版二部(中國網(wǎng)財經(jīng)編者注:《中華人民共和國藥典》是國家監(jiān)督管理藥品質(zhì)量的法定技術(shù)標(biāo)準(zhǔn)。)明文規(guī)定,溶液型靜脈用注射液、注射用濃溶液 20支(瓶)供試品中,均不得檢出可見異物。對于產(chǎn)品檢測“可見異物”的解釋,中國網(wǎng)在查閱相關(guān)醫(yī)藥資料后了解到,近年來,注射劑抽驗(yàn)中可見異物不合格率持續(xù)居于高位;在此類藥品中,如果在制造過程中混有可見異物,就會影響公眾的用藥安全,如若違規(guī)使用此類藥物,會產(chǎn)生副作用如過敏反應(yīng)、微循環(huán)障礙、血管栓塞等,嚴(yán)重時危及患者生命,也會給企業(yè)帶來不良影響。
對于屢次出現(xiàn)主要產(chǎn)品質(zhì)量問題,利泰制藥在招股書提出“嚴(yán)格控制原輔材料質(zhì)量、選用高品質(zhì)的藥品包裝材料、對生產(chǎn)環(huán)節(jié)的質(zhì)量控制、建立產(chǎn)品入庫前檢驗(yàn)制度、改善外包裝材料、加強(qiáng)儲存管理,協(xié)調(diào)經(jīng)銷商加強(qiáng)銷售環(huán)節(jié)的運(yùn)輸、儲存管理”等解決方案。
兩大經(jīng)銷商曾深陷商業(yè)賄賂丑聞
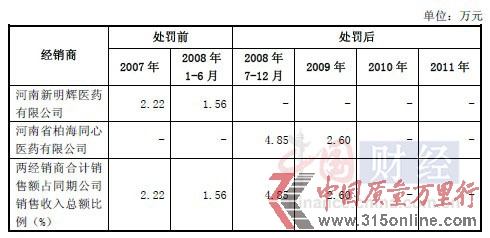
另外,中國網(wǎng)財經(jīng)還發(fā)現(xiàn),利泰制藥的經(jīng)銷商河南新明輝醫(yī)藥有限公司、河南省柏海同心醫(yī)藥有限公司曾經(jīng)陷入商業(yè)賄賂事件,并因此被河南省衛(wèi)生廳列入黑名單。
資料顯示,2007年底,有30多家藥品生產(chǎn)、經(jīng)營企業(yè)在河南省一些醫(yī)院的個別科室搞藥品臨床促銷,給予對方回扣,其中就包括了利泰制藥的經(jīng)銷商河南新明輝醫(yī)藥有限公司、河南省柏海同心醫(yī)藥有限公司。利泰制藥對以上兩家經(jīng)銷商銷售復(fù)方氨基酸(18AA-Ⅳ)麥克靈大輸液情況如下: